













中国农业科学 ›› 2025, Vol. 58 ›› Issue (8): 1479-1493.doi: 10.3864/j.issn.0578-1752.2025.08.002
汪炜檬1,2( ), 魏云晓2, 唐云霓2, 刘苗苗2, 陈全家1, 邓晓娟1(
), 魏云晓2, 唐云霓2, 刘苗苗2, 陈全家1, 邓晓娟1( ), 张锐2(
), 张锐2( )
)
收稿日期:2024-09-26
接受日期:2024-11-23
出版日期:2025-04-16
发布日期:2025-04-21
通信作者:
联系方式:
汪炜檬,E-mail:2327227097@qq.com。
基金资助:
WANG WeiMeng1,2( ), WEI YunXiao2, TANG YunNi2, LIU MiaoMiao2, CHEN QuanJia1, DENG XiaoJuan1(
), WEI YunXiao2, TANG YunNi2, LIU MiaoMiao2, CHEN QuanJia1, DENG XiaoJuan1( ), ZHANG Rui2(
), ZHANG Rui2( )
)
Received:2024-09-26
Accepted:2024-11-23
Published:2025-04-16
Online:2025-04-21
摘要:
【背景】棉花是全球最主要的农作物之一,生物工程技术应用极大地提高了分子育种的效率,但棉花遗传转化目前存在受基因型限制、时间长和转化方法单一等问题。【目的】建立由发根农杆菌(Agrobacterium rhizogenes)介导的高效棉花遗传转化体系,丰富棉花遗传育种方法。【方法】以常用的棉花受体WC和R18为主要试验材料,利用mRUBY作为报告基因,通过诱导生根的激素组合和浓度的筛选优化、不同外植体和不同基因型棉花生根体系差异分析来对发根农杆菌介导的生根过程进行优化,在此基础上建立稳定的遗传转化体系,并将该体系应用于基因编辑。【结果】在生根培养基(RIM)中添加萘乙酸(naphthaleneacetic acid,NAA)和洛伐他汀(lovastatin)比单独添加NAA,或添加NAA+吲哚-3-丁酸(indole-3-butyric acid,IBA)、NAA+Lovastatin+IBA更易生根,进一步筛选出最适合诱导出毛状根的萘乙酸和洛伐他汀浓度均为2 mg·L-1。子叶是最易诱导生根的外植体,WC子叶、子叶节和下胚轴单位材料的生根效率分别为398%、72%和39%,且子叶诱导生根时间最短(7 d),比子叶节至少短3 d,比下胚轴至少短8 d;R18最适合诱导生根的外植体也是子叶,但生根数量存在差异。基因型比较表明WC、R18、农大棉8号(NDM8)、新陆早61号(XLZ61)、Gb-1和Gb-2每片子叶在侵染后20 d的生根效率分别为398%、116%、199%、103%、57%和0,陆地棉的生根效率均在100%以上,海岛棉在100%以下,其中Gb-2在侵染后35 d才开始生根,陆地棉中常用的受体品种又表现出生根效率略高于生产品种的趋势。遗传转化的阳性率与生根率之间存在一定的差异,侵染后20 d NDM8、XLZ61、Gb-1和Gb-2的转化阳性率依次为59.8%、16.0%、38.5%和0。此外,以获得的阳性根作为后续试验的外植体,进行非胚性愈伤和胚性愈伤诱导,获得了转mRUBY植株,建立了完整的遗传转化体系,且发现植株颜色深浅和mRUBY表达量成正相关;同时获得了GhGI被编辑的棉花植株。【结论】优化了发根农杆菌介导的棉花生根过程,并建立了棉花遗传转化体系,同时成功将该体系应用于基因编辑,获得了转mRUBY和转GhGI的棉花植株。
汪炜檬, 魏云晓, 唐云霓, 刘苗苗, 陈全家, 邓晓娟, 张锐. 棉花发根农杆菌转化体系的建立及生根优化[J]. 中国农业科学, 2025, 58(8): 1479-1493.
WANG WeiMeng, WEI YunXiao, TANG YunNi, LIU MiaoMiao, CHEN QuanJia, DENG XiaoJuan, ZHANG Rui. Establishment and Rooting Optimization of Agrobacterium rhizogenes Transformation System in Cotton[J]. Scientia Agricultura Sinica, 2025, 58(8): 1479-1493.
表1
遗传转化所用培养基"
| 培养基Medium | 培养基成分Medium component |
|---|---|
| 液体1/2 MS Liquid 1/2 MS | 2.22 g·L-1 MS粉末+15 g·L-1葡萄糖,pH 5.8 2.22 g·L-1 MS powder+15 g·L-1 glucose, pH 5.8 |
| 共培养基A1 Co-culture medium A1 | MS+0.2 mg·L-1萘乙酸+40 mg·L-1乙酰丁香酮+30 g·L-1葡萄糖+2.5 g·L-1植物凝胶,pH 5.8 MS+0.2 mg·L-1 NAA+40 mg·L-1 acetosyringone (AS)+30 g·L-1 glucose+2.5 g·L-1 gelling agents, pH 5.8 |
| 生根培养基 Root inducing medium (RIM) | MS+250 mg·L-1 噻孢霉素+30 g·L-1葡萄糖+2.5 g·L-1植物凝胶,pH 5.8 MS+250 mg·L-1 cefotaxime nasalt+30 g·L-1 glucose+2.5 g·L-1 gelling agents, pH 5.8 |
| 愈伤诱导培养基 Callus inducing medium (CIM) | 4.44 g·L-1 MS粉末+0.1 mg·L-1二氯苯氧乙酸+0.1 mg·L-1激动素+250 mg·L-1噻孢霉素+30 g·L-1葡萄糖+2.5 g·L-1植物凝胶,pH 5.8 4.44 g·L-1 MS powder+0.1 mg·L-1 2,4-D+0.1 mg·L-1 KT+250 mg·L-1 cefotaxime nasalt+30 g·L-1 glucose+2.5 g·L-1 gelling agents, pH 5.8 |
| 分化培养基 Shoot inducing medium (SIM) | 4.44 g·L-1 MS+30 g·L-1葡萄糖+2.5 g·L-1植物凝胶,pH 6.5 4.44 g·L-1 MS+30 g·L-1 glucose+2.5 g·L-1 gelling agents, pH 6.5 |
| 长苗培养基 Seedling medium (SM) | 2.652 g·L-1 MS+10 mL·L-1 B5有机+1 g·L-1 谷氨酰胺+0.5 g·L-1 L-天冬酰胺+30 g·L-1葡萄糖+2.5 g·L-1植物凝胶,pH 6.5 2.652 g·L-1 MS+10 mL·L-1 B5 organic+1 g·L-1 glutamine (Gln)+0.5 g·L-1 L-asparagine (Asn)+30 g·L-1 glucose+ 2.5 g·L-1 gelling agents, pH 6.5 |
表2
生根培养基中激素的配比"
| 名称 Name | 激素 Hormone | 激素浓度 Hormone concentration (mg·L-1) | 名称 Name | 激素 Hormone | 激素浓度 Hormone concentration (mg·L-1) | |
|---|---|---|---|---|---|---|
| N | NAA | 0.2 | NL-4 | NAA, Lovastatin | 0.2, 3 | |
| NI | NAA, IBA | 0.2, 0.1 | NL-5 | NAA, Lovastatin | 0.2, 5 | |
| NL | NAA, Lovastatin | 0.2, 2 | NL-6 | NAA, Lovastatin | 0.1, 2 | |
| NLI | NAA, Lovastatin, IBA | 0.2, 2, 0.1 | NL-7 | NAA, Lovastatin | 1, 2 | |
| NL-1 | NAA, Lovastatin | 0.2, 0.1 | NL-8 | NAA, Lovastatin | 2, 2 | |
| NL-2 | NAA, Lovastatin | 0.2, 1 | NL-9 | NAA, Lovastatin | 3, 2 | |
| NL-3 | NAA, Lovastatin | 0.2, 2 |
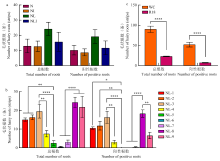
图2
棉花子叶于不同培养基上诱导生根情况 a:WC子叶侵染p35S-mRUBY后于N、NI、NL和NLI培养基上培养20 d的生根数量和阳性根数量Root numbers and positive root numbers of WC cotyledons infected with p35S-mRUBY after 20 days of culture on N, NI, NL, and NLI media;b:WC子叶侵染p35S-mRUBY后于NL-1—NL-9培养基上培养20 d的生根数量和阳性根数量Root numbers and positive root numbers of WC cotyledons infected with p35S-mRUBY after 20 days of culture on NL-1 to NL-9 media;c:WC和R18子叶侵染p35S-mRUBY后于NL-8培养基上培养20 d的生根数量和阳性根数量Root numbers and positive root numbers of WC and R18 cotyledons infected with p35S-mRUBY after 20 days of culture on NL-8 medium 数据为平均值±标准误Data are expressed as mean±SE。*P<0.05;**P<0.01;***P<0.0005;****P<0.0001。下同The same as below"
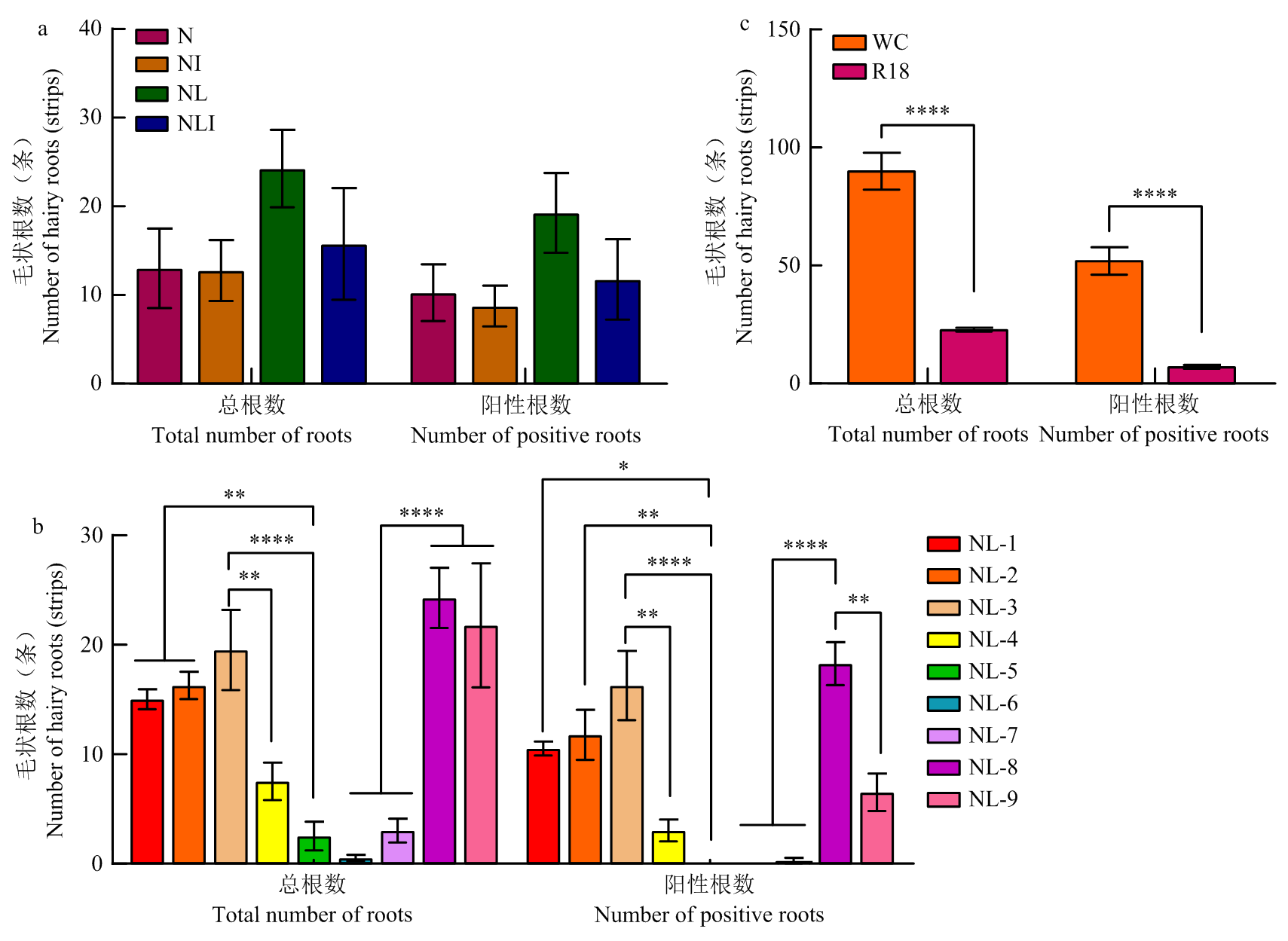
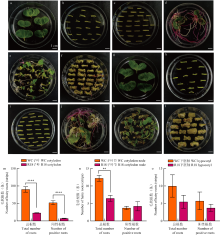
图3
WC和R18的不同外植体诱导生根比较 a、b、c:WC子叶、子叶节和下胚轴侵染后0 d WC cotyledons, cotyledonary nodes, and hypocotyls at 0 dpi;d、e、f:WC子叶、子叶节和下胚轴侵染后20、30和45 d的生根情况Rooting status of WC cotyledons, cotyledonary nodes, and hypocotyls at 20, 30, and 45 dpi;g、h、i:R18子叶、子叶节和下胚轴侵染转基因农杆菌(p35S-mRUBY)后0 d R18 cotyledons, cotyledonary nodes, and hypocotyls at 0 dpi with Agrobacterium (p35S-mRUBY);j、k、l:R18子叶、子叶节和下胚轴侵染后20、30和45 d生根情况Rooting status of R18 cotyledons, cotyledonary nodes, and hypocotyls at 20, 30, and 45 dpi;m:WC和R18子叶侵染后20 d生根数量及阳性根数统计Root numbers and positive root numbers for WC and R18 cotyledons at 20 dpi;n:WC和R18子叶节侵染后30 d生根数量及阳性根数统计Root numbers and positive root numbers for WC and R18 cotyledonary nodes at 30 dpi;o:WC和R18下胚轴侵染后45 d生根数量及阳性根数统计Root numbers and positive root numbers for WC and R18 hypocotyls at 45 dpi"

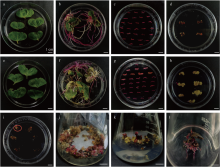
图6
发根农杆菌介导的棉花遗传转化过程 a—d:受体材料WC由转基因农杆菌p35S-mRUBY侵染后毛状根及愈伤组织的诱导Induction of hairy roots and callus in WC explants infected with Agrobacterium p35S-mRUBY;e—l:受体材料R18由转基因农杆菌p35S-mRUBY侵染后毛状根、愈伤组织及体细胞胚的诱导Induction of hairy roots, callus, and somatic embryos in R18 explants infected with Agrobacterium p35S-mRUBY;a、e:侵染后0 d子叶Cotyledons at 0 dpi;b、f:侵染后20 d,大量毛状根出现(红色为阳性根,白色为阴性根)Emergence of abundant hairy roots at 20 dpi (red: positive roots; white: negative roots);c、g:阳性根诱导愈伤组织0 d Positive root induced callus for 0 d;d、h:阳性根诱导愈伤组织90 d,阳性产生的愈伤颜色深浅不一,且体积较小Positive root induced callus for 90 d: Heterogeneous callus with small-sized tissues;i:阳性根诱导胚性愈伤135 d,有体细胞胚出现Positive root induced callus for 135 d: Embryogenic callus with somatic embryos;j:体细胞胚出现后继续培养至165 d,有红色的阳性嫩芽出现After the somatic embryos appeared, the somatic embryos were cultured to 165 d: Red-positive shoots emerging from somatic embryos;k:培养约195 d阳性芽渐渐长大,真叶展开Cultured to 195 d: Enlarged positive shoots with expanded true leaves;l:培养约220 d时,长成转mRUBY的阳性苗Cultured to 220 d: Mature mRUBY-transformed seedlings"
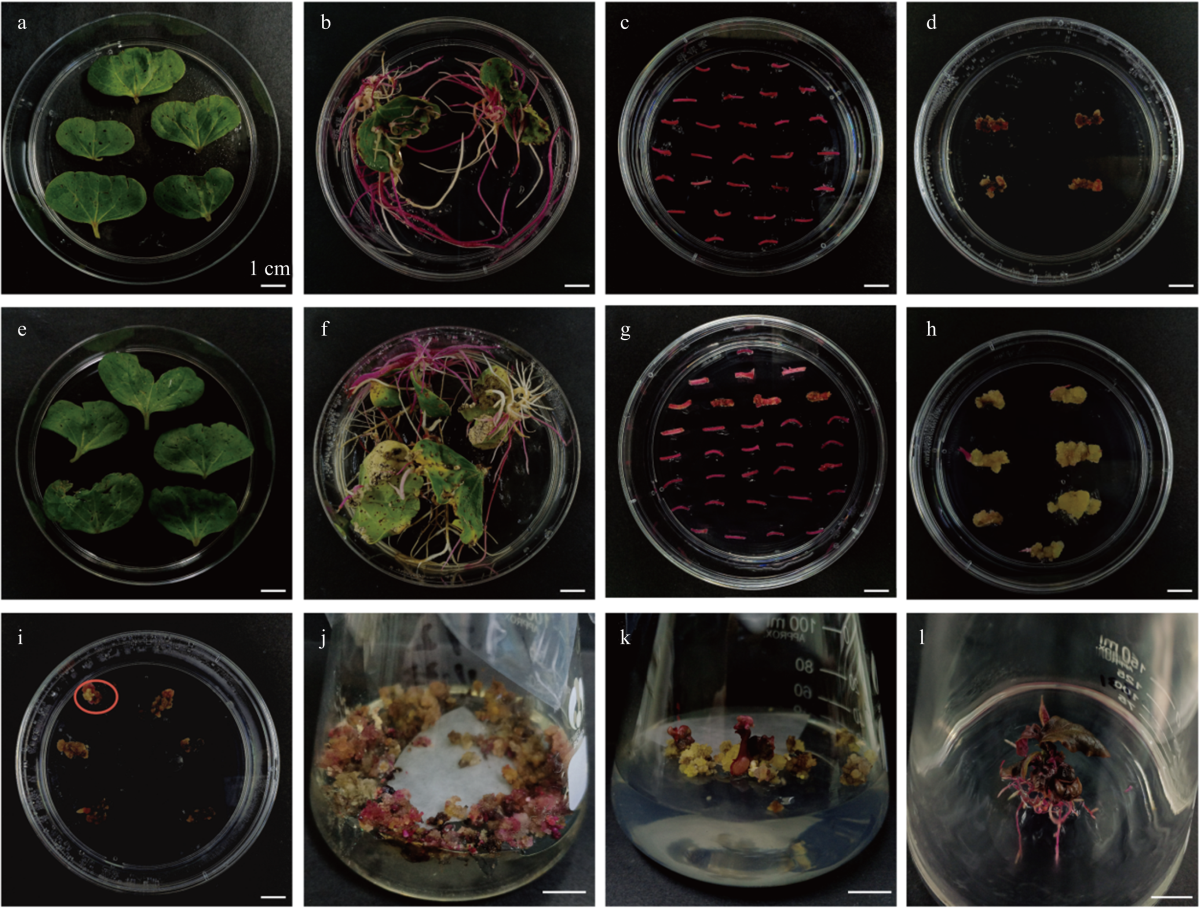
图7
WC毛状根不定芽诱导 a:6-BA 0.5 mg·L-1、NAA 0.1 mg·L-1处理下不定芽的诱导,根段有愈伤出现6-BA 0.5 mg·L-1+NAA 0.1 mg·L-1: Callus formation on root segments;b:6-BA 2 mg·L-1、NAA 0.1 mg·L-1处理下不定芽的诱导,部分根段死亡6-BA 2 mg·L-1+ NAA0.1 mg·L-1: Partial root segment death;c:6-BA 4 mg·L-1、NAA 0.2 mg·L-1处理下不定芽的诱导,根段有愈伤出现6-BA 4 mg·L-1+NAA 0.2 mg·L-1: Callus formation on root segments;d:6-BA 10 mg·L-1、NAA 0.2 mg·L-1处理下不定芽的诱导,根段死亡6-BA 10 mg·L-1+NAA 0.2 mg·L-1: Root segment death;e:6-BA 2 mg·L-1、NAA 2 mg·L-1处理下不定芽的诱导,部分根段死亡6-BA 2 mg·L-1+NAA 2 mg·L-1: Partial root segment death"
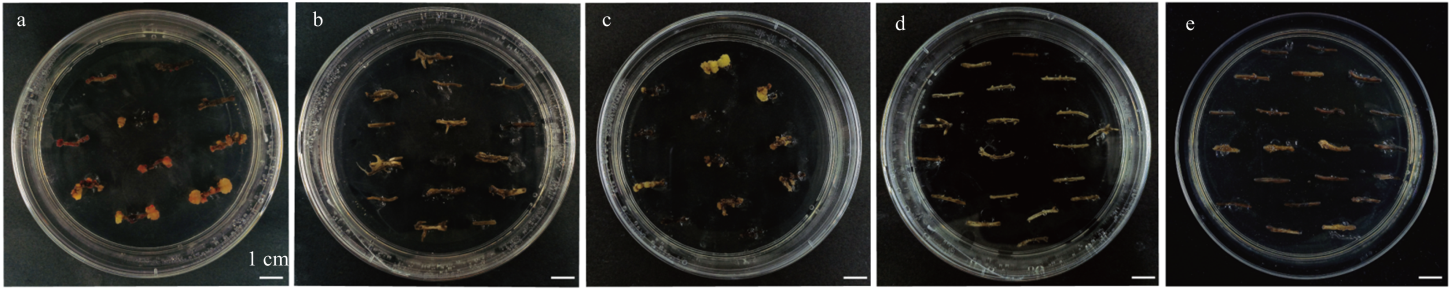
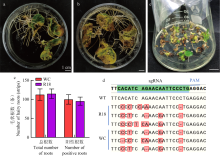
图8
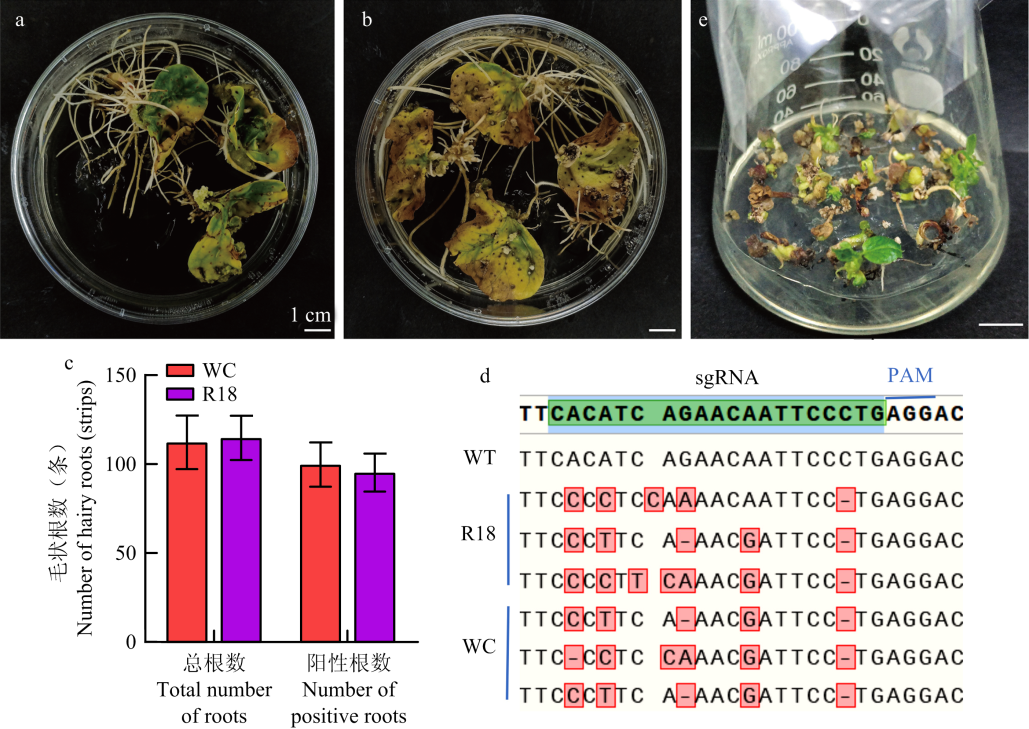
pCas9-GFP侵染WC和R18子叶后的生根及基因编辑情况 a:WC侵染后20 d的生根情况Rooting status of WC at 20 dpi;b:R18侵染后20 d的生根情况Rooting status of R18 at 20 dpi;c:WC和R18侵染后20 d毛状根总数及阳性根数Total hairy roots and positive root numbers for WC and R18 at 20 dpi;d:阳性根测序结果,图中显示实现了GhGI的编辑Sequencing results of positive roots confirming GhGI editing;e:基因编辑的幼苗Phenotype of gene-edited seedlings"
| [1] |
李梓秋. 四大棉花生产国的产业现状及特点. 农经, 2021(5): 90-95.
|
|
|
|
| [2] |
贾士荣, 郭三堆, 安道昌, 夏桂先. 转基因棉花. 北京: 科学出版社, 2001.
|
|
|
|
| [3] |
许智宏, 张宪省, 苏英华, 胡玉欣, 徐麟, 王佳伟. 植物细胞全能性和再生. 中国科学 (生命科学), 2019, 49(10): 1282-1300.
|
|
|
|
| [4] |
魏延宏, 马玲玲, 何兰兰, 柴蒙亮, 朱华国, 孙杰, 张薇. 农杆菌介导海岛棉茎尖遗传转化体系的建立. 农业生物技术学报, 2014, 22(10): 1242-1250.
|
|
|
|
| [5] |
|
| [6] |
陈虹地. 大豆胚尖遗传转化体系的优化及CHS8, MYB12b2基因的遗传转化[D]. 长春: 吉林大学, 2014.
|
|
|
|
| [7] |
杨艳丽. 双抗虫基因转化欧美杨107杨的研究[D]. 保定: 河北农业大学, 2012.
|
|
|
|
| [8] |
郭利军. 农杆菌介导巨桉无性系Eg5遗传转化的研究[D]. 北京: 中国林业科学研究院, 2012.
|
|
|
|
| [9] |
|
| [10] |
doi: 10.1111/jipb.13593 |
| [11] |
doi: 10.1111/pbi.14318 pmid: 38425137 |
| [12] |
|
| [13] |
|
| [14] |
张程程. 发根农杆菌介导的棉花遗传转化的研究[D]. 北京: 中国农业科学院, 2011.
|
|
|
|
| [15] |
|
| [16] |
朱华国, 张献龙, 金双侠, 刘冠泽. 两种常用激素组合下棉花体细胞胚胎发生过程的组织学观察. 棉花学报, 2012, 24(2): 159-166.
doi: 10.11963/cs120210 |
|
|
|
| [17] |
张伟艳, 朱滨杰, 时健, 韩阳瑞, 朱秀秀, 范玉朋. 不同质量浓度的IAA、NAA处理对尤加利种子萌发的影响. 南方农业, 2024, 18(5): 13-17.
|
|
|
|
| [18] |
丁喜莲. 农杆菌介导的海岛棉转Bt基因遗传转化研究[D]. 乌鲁木齐: 新疆农业大学, 2015.
|
|
|
|
| [19] |
娄亚芳. 棉花毛状根转化体系的建立[D]. 保定: 河北农业大学, 2018.
|
|
|
|
| [20] |
|
| [21] |
王清连, 王敏, 师海荣. 植物激素对棉花体细胞胚胎发生的诱导及调节作用. 生物技术通讯, 2004, 15(6): 577-579.
|
|
|
|
| [22] |
张献龙, 孙济中, 刘金兰. 陆地棉体细胞胚胎发生与植株再生. 遗传学报, 1991, 18(5): 461-467.
|
|
|
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
pmid: 16315034 |
| [27] |
|
| [28] |
李凯利, 魏云晓, 种智力, 孟志刚, 王远, 梁成真, 陈全家, 张锐. 红蓝光促进陆地棉愈伤组织诱导和增殖. 中国农业科学, 2024, 57(4): 638-649. doi: 10.3864/j.issn.0578-1752.2024.04.002.
|
|
|
|
| [29] |
魏进莉. 荷包牡丹的组培快繁技术研究. 天津农业科学, 2022, 28(4): 10-14.
|
|
|
|
| [30] |
王国熙. 木槿组培快繁技术研究. 安徽农学通报, 2017, 23(11): 54-57.
|
|
|
|
| [31] |
|
| [32] |
doi: 10.3389/fpls.2016.01082 pmid: 27504114 |
| [33] |
|
| [34] |
|
| [35] |
赵陆滟, 李荣平, 吴劲松. 渐狭叶烟草组培苗生根条件优化及在基因转化中的应用. 亚热带植物科学, 2021, 50(3): 175-181.
|
|
|
|
| [36] |
doi: S1369-5266(19)30077-9 pmid: 31726426 |
| [37] |
罗晓丽, 姜艳丽, 肖娟丽, 武宗信, 张安红, 王志安, 吴家和. 早熟棉体细胞胚胎发生和植株再生体系的建立. 西北植物学报, 2011, 31(3): 609-615.
|
|
|
|
| [38] |
乐愉, 王涛, 张献龙, 林忠旭. 陆地棉重组自交系再生能力和遗传转化效率筛选. 作物学报, 2024, 50(5): 1172-1180.
doi: 10.3724/SP.J.1006.2024.34167 |
|
|
|
| [39] |
李静, 张换样, 朱永红, 吴慎杰, 焦改丽. 农杆菌介导棉花遗传转化的影响因素. 南方农业, 2020, 14(22): 8-12, 28.
|
|
|
| [1] | 赵宇萱, 苗纪元, 胡伟, 周治国. 苗期低温对棉花花芽分化和棉株产量的影响[J]. 中国农业科学, 2025, 58(7): 1311-1320. |
| [2] | 罗刚, 程依依, 杨雯, 肖怡梦, 杨铖熹. CRISPR-Cas12a基因编辑技术及其在农业生产中的应用[J]. 中国农业科学, 2025, 58(7): 1434-1450. |
| [3] | 靳亚茹, 陈斌, 王歆凯, 周田田, 李笑, 邓晶晶, 杨郁文, 郭冬姝, 张保龙. 利用基因编辑产生长片段缺失创制低谷蛋白水稻种质[J]. 中国农业科学, 2025, 58(6): 1052-1064. |
| [4] | 田立文, 娄善伟, 张鹏忠, 杜明伟, 罗宏海, 李杰, 帕尔哈提·买买提, 马腾飞, 张立祯. 绿色高效生产模式下新疆棉花单产提升面临问题与途径分析[J]. 中国农业科学, 2025, 58(6): 1102-1115. |
| [5] | 徐以恒. “基因编辑农作物”专利规制的困境及出路[J]. 中国农业科学, 2025, 58(5): 831-839. |
| [6] | 许娜, 唐颖, 徐正进, 孙健, 徐铨. 籼粳杂种不育的遗传分析和候选基因鉴定[J]. 中国农业科学, 2024, 57(8): 1417-1429. |
| [7] | 吴玉珍, 黄龙雨, 周大云, 黄义文, 付守阳, 彭军, 匡猛. 中国棉花审定品种SSR指纹库的构建与综合评价[J]. 中国农业科学, 2024, 57(8): 1430-1443. |
| [8] | 雷建峰, 尤扬子, 张锦恩, 代培红, 于莉, 杜正阳, 李月, 刘晓东. 靶向敲除棉花GhAGL16高效sgRNA的筛选[J]. 中国农业科学, 2024, 57(6): 1023-1033. |
| [9] | 韩立杰, 才宏伟. 高粱遗传转化研究进展[J]. 中国农业科学, 2024, 57(3): 454-468. |
| [10] | 赵婕, 赵龙缘, 潘凝辉, 管丽蓉, 杜云龙, 李成云, 王云月, 谢勇. 水解酶基因BGIOSGA023826在稻瘟菌侵染过程中的抗病表型效应[J]. 中国农业科学, 2024, 57(23): 4607-4618. |
| [11] | 张永莉, 张宁, 徐姣, 许豆豆, 成芳, 张成龙, 吴碧波, 巩养仓, 贺云新, 魏尚职, 屠小菊, 刘爱玉, 周仲华. 不同带状间作模式对棉花生长发育和生产力的影响[J]. 中国农业科学, 2024, 57(22): 4444-4458. |
| [12] | 何静, 王振华, 刘健, 马占利, 温越. 灌溉水温与施氮量对滴灌棉田土壤水热及棉花生长和产量的影响[J]. 中国农业科学, 2024, 57(2): 319-335. |
| [13] | 武玉花, 翟杉杉, 普豪祯, 高鸿飞, 张华, 李俊, 李允静, 肖芳, 吴刚, 徐利群. 农业用植物基因编辑产品检测方法研究进展[J]. 中国农业科学, 2024, 57(17): 3318-3334. |
| [14] | 曹鹏, 周金环, 王新亮, 李楚欣, 李佳欣, 姜培, 刘金香, 宋震. 发根农杆菌介导的柑橘黄龙病抗性快速评价体系优化及应用[J]. 中国农业科学, 2024, 57(16): 3182-3191. |
| [15] | 白冰楠, 乔丹, 葛群, 栾玉娟, 刘小芳, 卢全伟, 牛皓, 龚举武, 巩万奎, ELAMEER ELSAMMAN, 闫浩亮, 李俊文, 刘爱英, 石玉真, 王海泽, 袁有禄. 陆地棉棉籽相关性状的QTN挖掘及候选基因筛选[J]. 中国农业科学, 2024, 57(15): 2901-2913. |
|
||